PO4 là một gốc hóa học quen thuộc với các hợp chất đó là axit H3PO4 và các muối photphat. Trong nội dung bài viết này, chúng ta sẽ tìm hiểu gốc PO4 hóa trị mấy và tính chất của một số chất gốc PO4.

PO4 hóa trị mấy?
Câu hỏi: PO4 có hóa trị bao nhiêu?
Trả lời: PO4 có hóa trị III.
Chúng ta có thể dễ dàng nhận thấy hóa trị của PO4 khi kết hợp với các ion khác để tạo thành một hợp chất. Khi đó, PO4 đều có hóa trị III.
Một số hợp chất gốc PO4
Axit Photphoric H3PO4
Axit photphoric H3PO4 là một axit trung bình. H3PO4 tồn tại ở dạng siro lỏng, không màu, không mùi, dễ tan trong nước và rượu, không độc.
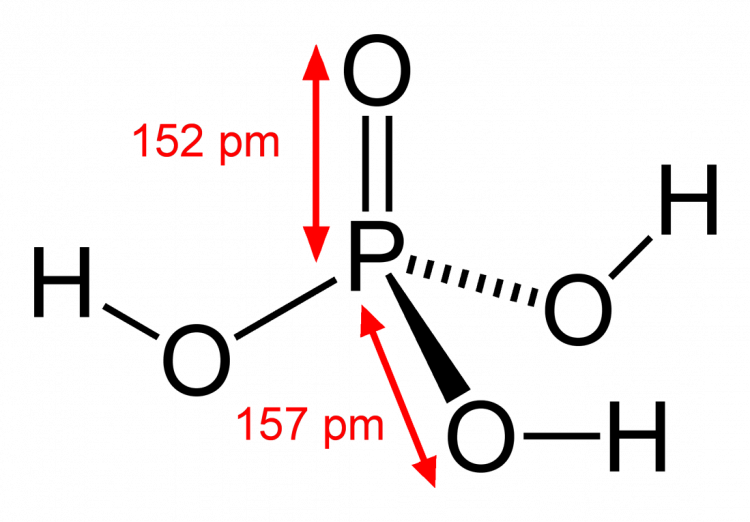
H3PO4 có các tính chất hóa học như sau:
Phân li thuận nghịch trong dung dịch
H3PO4 là một axit trung bình bị phân li thuận nghịch theo 3 mức sau:
H3PO4 ↔ H+ + H2PO4–
H2PO4– ↔ 2H+ + HPO42-
HPO42- ↔ 3H+ + PO43-
Làm quỳ tím chuyển thành màu đỏ
Tác dụng với oxit bazơ
Phương trình hóa học:
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
Tác dụng với bazơ
Sản phẩm là các muối khác nhau tùy theo tỉ lệ các chất tham gia phản ứng
Phương trình hóa học:
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
Tác dụng với kim loại đứng trước H2
Phương trình hóa học:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Tác dụng với muối
Phương trình hóa học:
H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
Tính oxi hóa – khử của axit photphoric
Trong axit H3PO4, P có mức oxi hóa +5 là mức oxi hóa cao nhất nhưng H3PO4 không có tính oxi hóa như HNO3 vì nguyên tử P có bán kính lớn hơn so với bán kính của N làm cho mật độ điện dương trên P nhỏ nên khả năng nhận electron yếu hơn.
Một số phản ứng do tác dụng của nhiệt
2H3PO4 → H4P2O7 + H2O (nhiệt độ từ 200 – 250 độ C)
H4P2O7 → 2HPO3 + H2O (nhiệt độ từ 400 – 500 độ C)
Điều chế axit H3PO4
Điều chế trong phòng thí nghiệm:
P + 5HNO3 đặc →H3PO4 + 5NO2 + H2O (t0)
Điều chế trong công nghiệp:
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (nhiệt độ)
Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
Cách nhận biết Axit H3PO4
- H3PO4 làm quỳ tím chuyển thành màu đỏ.
- Tạo kết tủa vàng với dung dịch AgNO3.
Muối Photphat
Muối photphat là muối của axit photphoric. Muối photphat có 3 loại đó là gốc photphat (PO43-), muối hidrophotphat (HPO42- ) và muối đihidrophotphat (H2PO4–).
Tất cả muối H2PO4– đều tan; muối PO43- và HPO42- chỉ có muối của kim loại kiềm và amoni tan được.

Muối photphat có đầy đủ các tính chất của muối. Bên cạnh đó còn có thêm một số tính chất sau:
Muối photphat kim loại kiềm dễ bị thủy phân
Các muối photphat của kim loại kiềm dễ bị thủy phân trong dung dịch tạo môi trường bazơ:
Ví dụ:
Na3PO4 → 3Na+ + PO43-
PO43- + H2O → HPO42- + OH–
Muối axit (H2PO4–, HPO42-) còn biểu hiện tính chất của axit.
NaH2PO4 + NaOH → Na2HPO4 + H2O
Điều chế muối photphat
Để tạo ra muối photphat thì cho P2O5 hoặc H3PO4 tác dụng với dung dịch kiềm hoặc dùng phản ứng trao đổi ion.
Cách nhận biết muối photphat
Nhận biết ion PO43- bằng dung dịch AgNO3, phản ứng tạo ra kết tủa màu vàng.
3Ag+ + PO43- → Ag3PO4 (kết tủa vàng)
Trên đây là giải đáp cho câu hỏi “PO4 hóa trị mấy” và những thông tin về các hợp chất gốc PO4. Mong rằng, qua bài viết này sẽ giúp bạn hiểu rõ hơn về gốc PO4, từ đó áp dụng hiệu quả cho quá trình học tập và nghiên cứu.