Phản ứng thế được học trong chương trình hóa học lớp 8. Chúng ta sẽ cùng tìm hiểu chi tiết hơn về phản ứng thế và các bài tập liên quan nhé.
Phản ứng thế là gì?
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất. Trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác ở trong hợp chất. (Theo SGK Hóa học lớp 8).
Bản chất của phản ứng thế là một phản ứng hóa học mà một nguyên tố có hoạt động hóa học mạnh hơn sẽ thay thế cho các nguyên tố có hoạt động hóa học yếu hơn trong các hợp chất tham gia phản ứng.
Bạn có thể hiểu rõ hơn theo ví dụ dưới đây:
Fe + 2HCl → FeCl2 + H2 (1)
Phản ứng (1) được gọi là phản ứng thế: Đơn chất là Fe, hợp chất là HCl. Fe đã thay thế nguyên tử H trong HCl.

Cách phân loại phản ứng thế
Phản ứng thế xảy ra ở cả trong hóa học vô cơ và hữu cơ, chúng ta sẽ tìm hiểu chi tiết cách phân loại như sau.
Phản ứng thế trong hóa học vô cơ
Trong hóa học vô cơ, phản ứng thế xảy ra luôn đi kèm theo sự thay đổi số oxi hóa của các chất. Phản ứng xảy ra với điều kiện cụ thể về nhiệt độ và áp suất cụ thể tùy theo từng trường hợp.
Phương trình phản ứng minh họa về phản ứng thế trong hóa học vô cơ: A + BX → AX + B
Một số phương trình hóa học phản ứng thế trong vô cơ
2Al + 6HCl → 2AlCl3 + 3H2
Zn + CuCl2 → Cu + ZnCl2
3Cl2 + 2NH3 → 6HCl + N2

Phản ứng thế trong hóa học hữu cơ
Trong hóa học hữu cơ, phản ứng thế lại được chia thành các loại như sau:
- Phản ứng thế gốc.
- Phản ứng thế ái lực điện tử.
- Phản ứng thế ái lực hạt nhân.
Phản ứng thế thường gặp ở các hydrocacbon no, ký hiệu là S. Đây là dạng phản ứng dây chuyền. Để khơi mào phản ứng thì cần phải chiếu sáng hoặc cho thêm các chất dễ phân hủy thành gốc tự do vào.
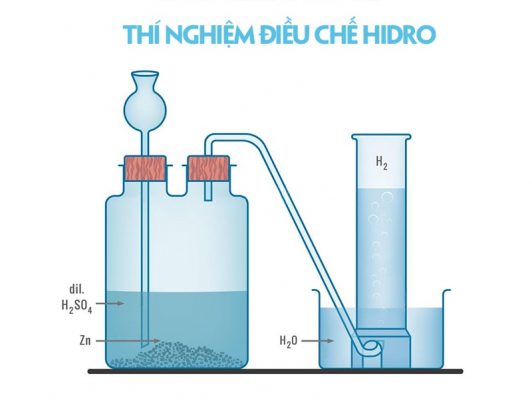
Cách điều chế hidro bằng phản ứng thế
Điều chế hidro trong phòng thí nghiệm
Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm).
Quá trình điều chế được thực hiện như sau:
- Cho kẽm (Zn) vào ống nghiệm.
- Nhỏ 2 – 3 ml dung dịch axit clohidric (HCl) vào ống nghiệm đó.
- Dùng nút cao su có ống dẫn khí xuyên qua để đậy ống nghiệm lại. Sau khi khử độ tinh khiết, khẳng định dòng khí hidro không có lẫn khí oxi. Bạn đưa que đóm còn tàn đỏ vào đầu ống dẫn khí thì que đóm cháy.
Phương trình hóa học điều chế Hidro trong phòng thí nghiệm:
Zn + 2HCl → ZnCl2 + H2
Lưu ý: HCl có thể được thay thế bằng H2SO4 loãng; Zn có thể được thay thế bằng Fe hoặc Al.
Nếu muốn điều chế lượng lớn hidro trong phòng thí nghiệm thì làm như sau:
- Đổ dung dịch axit HCl loãng vào phễu.
- Mở khóa cho dung dịch axit từ phễu chảy xuống lọ và tác dụng với kẽm.
- Thu khí hiđro vào ống nghiệm bằng cách để hidro nước hoặc không khí ra khỏi ống nghiệm.
Điều chế hidro trong công nghiệp
Trong công nghiệp sẽ có 3 cách điều chế khí hidro:
- Điện phân nước.
- Điều chế H2 từ khí tự nhiên, khí dầu mỏ.
- Dùng than khử oxi của nước (H2O) trong lò khí than.
Bài tập về phản ứng thế
Bài 1: Cho các phản ứng hoá học sau với điều kiện phản ứng có đủ.
(1): ZnO + 2HCl → ZnCl2 + H2O.
(2): 2Cu + O2 → 2CuO.
(3): Fe + 2HCl → FeCl2 + H2↑.
(4): 2KMnO4 → K2MnO4 + MnO2 + O2↑.
(5): 2Na + 2H2O → 2NaOH + H2↑.
(6): Na2O + H2O → 2NaOH.
Số phản ứng thế là:
- 1
- 2
- 3
- 4
Đáp án B
Các phản ứng thế là:
(3): Fe + 2HCl → FeCl2 + H2↑.
(5): 2Na + 2H2O → 2NaOH + H2↑.
Bài 2. Cho các kim loại kẽm và sắt và dung dịch HCl và H2SO4 loãng. Hãy viết các phương trình hóa học có thể điều chế hidro trong phòng thí nghiệm và cho biết chúng thuộc loại phản ứng nào?
Lời giải:
Các phương trình hóa học có thể điều chế hiđro:
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
Zn + H2SO4 (loãng) → ZnSO4 + H2↑
Fe + H2SO4 (loãng) → FeSO4 + H2↑
Cả 4 phản ứng hóa học đều thuộc loại phản ứng thế.
Bài 3. Trong các phản ứng sau, phản ứng nào là phản ứng thế?
A. Fe + 2HCl → FeCl2 + H2↑
B. Cu + 2FeCl3 → CuCl2 + 2FeCl2
C. NaOH + HCl → NaCl + H2O
D. CuO + 2HCl → CuCl2 + H2O
Đáp án A

Bài 4. Chọn đáp án đúng trong các phát biểu sau.
- Phản ứng giữa Fe và HCl là phản ứng thế.
- Phản ứng giữa FeO và HCl là phản ứng oxi hóa – khử.
- CaCO3 → CaO + CO2 là phản ứng oxi hóa khử.
- Khí H2 nặng hơn không khí.
Đáp án A
Bài 5. Phản ứng nào sau đây không phải là phản ứng thế?
- Mg +2HCl → MgCl2 +H2↑
- CuO + H2 → Cu + H2O
- Ca(OH)2 + CO2 → CaCO3↓ +H2O
- Zn + CuSO4 → ZnSO4 + Cu
Đáp án C
Bài 6. Phát biểu nào là đúng nhất?
- Phản ứng thế là phản ứng hóa học trong đó nguyên tử của đơn chất thế chỗ nguyên tử của nguyên tố khác trong hợp chất
- Phản ứng thế là phản ứng hóa học trong đó có sự tham gia của hợp chất và đơn chất tạo thành chất mới
- Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó có sự tham gia của hợp chất và các chất.
- Phản ứng thế là quá trình tạo thành nhiều chất mới từ 2 hay nhiều chất ban đầu
Đáp án A
Bài 7. Cho Fe phản ứng với HCl, đốt cháy khí sinh ra thu được ngọn lửa màu gì?
- Đỏ
- Xanh nhạt
- Cam
- Tím
Đáp án B
Lời giải:
Phương trình phản ứng giữa Fe và HCl:
Fe + 2HCl → FeCl2 + H2↑
Khí thoát ra là H2, cháy được trong không khí tạo ngọn lửa màu xanh nhạt.
Bài 8. Cho phản ứng 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 thu được 1.68 lít khí ở đktc. Tính khối lượng của Al đã phản ứng với H2SO4..
- 2,025 gam
- 5,240 gam
- 6,075 gam
- 1,350 gam
Đáp án D
Số mol khí H2 là: nH2 = 1.68/22.4 = 0,075 mol
Phương trình hóa học của phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Số mol Al là: nAl = ⅔ nH2 = 0.05 mol
Khối lượng Al đã phản ứng là: mAl = 0,05.27 = 1,35 gam
Bài 9. Cho 5,6 gam Fe tác dụng với dung dịch HCl (dư) thì thu được thể tích khí H2 (ở đktc) là bao nhiêu?
- 2,24 lít.
- 1,12 lít.
- 4,48 lít.
- 6,72 lít.
Đáp án A
Phương trình hóa học: Fe + 2HCl → FeCl2 + H2↑
Số mol Fe là: nFe = 5.6/56 = 0,1 mol
Theo phương trình hóa học thì nFe = nH2 = 0.1 mol
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,1 = 2,24 lít
Bài 10. Khi cho Zn tác dụng hoàn toàn với H2SO4 loãng, sau phản ứng tạo ra mấy sản phẩm?
- 1
- 2
- 3
- 4
Đáp án B
Phương trình hóa học: Zn + H2SO4 → ZnSO4 + H2↑
nên sau phản ứng tạo ra 2 sản phẩm: ZnSO4 và H2
Bài 11. Cho Mg tác dụng với dung dịch HCl thu được muối MgCl2 và 4,48 lít khí hiđro (ở đktc). Khối lượng axit HCl cần dùng cho phản ứng là bao nhiêu?
- 29,2 gam
- 14,6 gam
- 12,7 gam
- 10,95 gam
Đáp án B
Lời giải:
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2↑
Số mol H2 là: nH2 = 4.48/22.4 = 0,2 mol
Theo phương trình hóa học: nHCl = 2 x nH2 = 2 x 0.2 = 0.4 mol
Khối lượng HCl cần dùng là: mHCl = nHCl.MHCl = 0,4.36,5 =14,6 gam
Trên đây là những kiến thức về phản ứng thế và các bài tập áp dụng. Hy vọng bài viết đã cung cấp cho bạn nhiều thông tin thú vị về loại phản ứng hóa học này.