Phản ứng Cl2 + NaOH được gọi là phản ứng tạo ra nước Javen. Cùng tìm hiểu về phương trình, điều kiện xảy ra phản ứng và các bài tập liên quan đến phản ứng hóa học Cl2 NaOH nhé.
Phương trình phản ứng Cl2 + NaOH
Ta có phương trình phản ứng Clo ra nước Javen như sau:
Cl2 + 2NaOH → NaCl + NaClO + H2O

Điều kiện xảy ra phản ứng Cl2 NaOH
Phản ứng giữa Clo và dung dịch NaOH xảy ra ở điều kiện thường.
Cách thực hiện phản ứng Cl2 + NaOH ra nước Javen
Dẫn từ từ khí Cl2 vào ống nghiệm chứa dung dịch NaOH trong đó có quỳ tím.
Hiện tượng xảy ra khi Clo tác dụng với NaOH
Khi dẫn khí clo vào cốc đựng dung dịch NaOH loãng. Bạn nhúng một mẩu giấy quỳ tím vào dung dịch thu được dung dịch nước Javen. Quan sát thấy giấy quỳ tím bị mất màu.
Kiến thức về nước Javen
Khái niệm nước Javen là gì?
Nước Javen hay nước Giaven là một hợp chất được tạo thành bởi hai muối NaCl và NaClO khi sục khí Clo dư vào dung dịch Natri Hydroxit.

Nước Javen có đặc tính gì?
Nước Javen có tính oxi hóa mạnh và có tính chất tẩy rửa cực mạnh. Trong đó, NaClO là một axit có tính oxi hóa rất mạnh. Trong hợp chất này, Cl có số oxi hóa +1 nên có khả năng oxi hóa mạnh để trở về các số oxi hóa thấp hơn.
Tính oxi hóa mạnh của phân tử NaClO sẽ phá vỡ các hợp chất phức hữu cơ như các vết mực, vết màu dính trên quần áo, vật liệu. Đó là lý do mà nước Javen được dùng để tẩy các vết bẩn một cách hữu hiệu.
Nếu đã sử dụng các sản phẩm từ nước Javen thì bạn sẽ thấy hỗn hợp này có mùi xốc khi sử dụng.
NaClO phản ứng với axit theo phương trình dưới đây:
NaClO + 2HCl → NaCl + Cl2 + H2O
Khí Cl2 tạo thành có mùi xốc và sẽ làm ảnh hưởng xấu đến sức khỏe người nếu hít phải. Vì vậy, bạn cần cẩn thận khi sử dụng hóa chất này trong sinh hoạt và sản xuất.
Phương pháp điều chế nước javen trong phòng thí nghiệm
Để điều chế nước Javen trong phòng thí nghiệm thì người ta sử dụng một số phương pháp sau:
Phương pháp 1: Điều chế từ Clo và NaOH
Trong phòng thí nghiệm, nước javen được điều chế trực tiếp bằng cách cho khí Cl2 đi qua dung dịch NaOH ở nhiệt độ thường. Phản ứng sẽ tạo ra hỗn hợp dung dịch NaCl và nước giaven.
Phương trình phản ứng tạo nước Javen như sau:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Phương pháp 2: Điều chế từ MnO2 và HCl
Cho MnO2 phản ứng với dung dịch axit HCl để tạo ra khí clo. Khí Cl2 sinh ra sẽ được dẫn qua dung dịch NaOH và thu được nước Javen.
Các phương trình phản ứng như sau:
4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Cl2 + 2NaOH → NaCl + NaClO + H2O
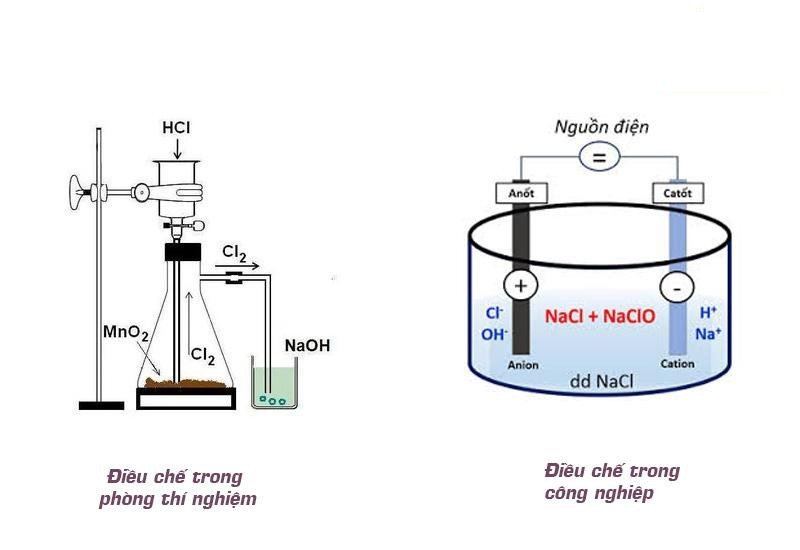
Cách điều chế nước javen trong công nghiệp
Trong công nghiệp, phương pháp phổ biến để điều chế nước Javen là sử dụng NaCl. Điện phân có màng ngăn dung dịch NaCl để tạo ra NaOH, khí Hydro và Clo. Sau đó, khí Clo tiếp tục phản ứng với dung dịch NaOH để tạo thành nước Javen.
Bài tập vận dụng liên quan đến phản ứng Cl2 + NaOH
Để ghi nhớ hơn về phản ứng giữa khí Clo và dung dịch NaOH tạo nước Javen, chúng ta cùng tham khảo một số bài tập kèm đáp án sau:
Bài 1: Nước Gia-ven là hỗn hợp gồm những chất nào sau đây?
- NaCl, NaClO3, H2O
- NaCl, NaClO4, H2O
- NaCl, NaClO, H2O
- HCl, HClO, H2O
Đáp án C
Bài 2. Nước Clo có tính tẩy màu vì:
- Vì clo tác dụng với nước tạo nên axit HCl có tính tẩy màu
- Vì khi dẫn khí clo vào nước không xảy ra phản ứng hoá học
- Vì clo hấp phụ được màu
- Vì clo tác dụng nước tạo nên axit HClO có tính tẩy màu
Đáp án D
Bài 3. Thành phần của nước clo gồm những chất nào?
- H2O, Cl2, HClO3
- HCl, HClO
- Cl2, HCl, HClO2
- Cl2, HCl, HClO
Đáp án D
Bài 4. Trong thí nghiệm Cl2 tác dụng với dung dịch NaOH ở nhiệt độ thường thì Cl2 đóng vai trò là:
2NaOH + Cl2 → NaCl + NaClO + H2O
- Chất nhận proton.
- Chất nhường proton.
- Chất nhường electron cho NaOH.
- Vừa là chất khử, vừa là chất oxi hóa.
Đáp án D
Phương trình phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Trong phản ứng này, Clo vừa là chất khử, vừa là chất oxi hoá khi vừa tăng và vừa giảm số electron.
Bài 5. Clo tồn tại chủ yếu ở dạng nào trong tự nhiên?
- Muối clorua
- Axit clohidric
- Muối natri clorat
- Đơn chất
Đáp án A

Bài 6. Cách thu khí clo trong phòng thí nghiệm là:
- Dẫn khí clo vào một bình được đậy bằng nút cao su có ống dẫn khí
- Dẫn khí clo vào một bình úp ngược sẵn
- Dẫn khí clo vào một bình nút bằng bông được tẩm dung dịch NaOH đặc
- Thu clo bằng cách dời chỗ của nước
Đáp án C
Bài 7. Tính chất nào sau đây của khí clo?
- Khí clo có màu vàng lục, tan ít trong nước, không độc
- Khí clo không màu, mùi xốc, tan ít trong nước, rất độc
- Khí clo có màu vàng lục, mùi xốc, tan ít trong nước, rất độc.
- Màu vàng lục, mùi hắc, tan nhiều trong nước, rất độc
Đáp án C
Khí Clo là một phi kim thuộc nhóm halogen. Ở điều kiện thường, clo tồn tại ở dạng khí, có màu vàng lục, ít tan trong nước và mùi rất hắc. Khí Clo tương đối độc, giống với brom.
Bài 8. Cách sản xuất khí Clo trong công nghiệp là:
- Điện phân dung dịch NaCl có màng ngăn xốp
- Điện phân dung dịch NaCl không có màng ngăn xốp
- Dùng khí Flo đẩy Cl2 khỏi dung dịch muối NaCl
- Nhiệt phân muối NH4Cl
Đáp án A
Trong công nghiệp, khí Clo được điều chế bằng cách điện phân dung dịch NaCl có màng ngăn xốp. Thùng điện phân có màng ngăn 2 điện cực để khí clo không tiếp xúc với dung dịch NaOH.
Phương trình phản ứng như sau:
2NaCl + 2H2O → 2NaOH + H2 + Cl2.
Bài 9. Cho 100 gam dung dich HCl 36,5% vào bình đựng 15,4 gam MnO2 và đun nhẹ. Thể tích khí clo (Đktc) thoát ra lớn nhất là bao nhiêu?
- 2,24 lít
- 3,36 lít
- 5,6 lít
- 4,48 lít
Đáp án D
Lời giải:
Phương trình phản ứng như sau:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Ta có:
Khối lượng của HCl là: mHCl = 36,5 gam => số mol của HCl: nHCl = 1,0 mol;
Số mol của MnO2 là: nMnO2 = 0,2 mol
Theo phương trình phản ứng ta có: nHCl = 4nMnO2 => HCl dư
nCl2 = nMnO2 = 0,2 mol
Vậy thể tích khí Cl2 lớn nhất thu được là: VCl2 = 0,1x 22,4 = 4,48 lít
Bài 10. Tính chất nào sau đây không phải là của khí Cl2?
- Tan hoàn toàn trong H2O tạo dung dịch Clo.
- Có màu vàng lục.
- Có tính tẩy trắng khi ẩm.
- Có mùi hắc, rất độc, sát trùng H2O.
Đáp án A
Khí Clo tan ít trong nước tạo thành dung dịch nước Clo.
Trên đây là những thông tin về phương trình hóa học, điều kiện xảy ra phản ứng Cl2 + NaOH. Các bài tập vận dụng sẽ giúp bạn hiểu sâu hơn về phản ứng Cl2 NaOH ra nước Javen.