Phản ứng nhiệt phân KClO3 trong chương trình học phổ thông với nhiều bài tập thú vị. Trong nội dung bài viết này, chúng ta sẽ tìm hiểu chi tiết hơn về phương trình phản ứng, điều kiện xảy ra, các tính chất của KClO3 và các bài tập vận dụng kèm lời giải nhé.
Phương trình nhiệt phân KClO3
Khi nhiệt phân muối Kali Clorat thì tùy theo mức nhiệt độ sẽ cho ra sản phẩm khác nhau.
Trường hợp 1. Nhiệt phân KClO3 ở nhiệt độ 400 độ C thì có phương trình hóa học:
4KClO3 → 3KClO4 + KCl
Trường hợp 2. Nhiệt phân KClO3 ở nhiệt độ 500 độ C thì có phương trình hóa học như sau:
2KClO3 → 2KCl + 3O2
Lưu ý: Phản ứng có thể xảy ra ở nhiệt độ dưới 500 độ C khi có chất xúc tác MnO2.
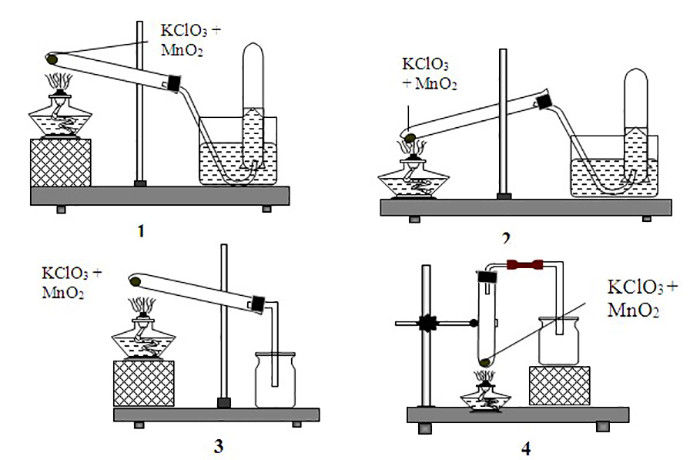
Phản ứng nhiệt phân KClO3 đơn thuần sẽ tạo ra 2 loại muối kali (KClO4 và KCl) nếu có xúc tác MnO2 hoặc nhiệt độ 500 độ C sẽ tạo ra khí O2 thoát ra và muối KCl. Đây là điều mà bạn cần quan tâm khi nhiệt phân Kali Clorat.
Tìm hiểu về muối KClO3
KClO3 có tên gọi là Kali Clorat, tồn tại ở dạng kết tinh màu trắng khi ở dạng tinh khiết. Nó là loại hóa chất được ứng dụng phổ biến trong công nghiệp và được xem là loại clorat có nhiều ứng dụng hiện nay.
Các tính chất đặc trưng của KClO3
- Kali Clorat tồn tại ở dạng tinh thể không màu hoặc màu trắng.
- Nó có vị mặn, lạnh và là chất độc, có thể gây ngộ độc hoặc tử vong nếu uống vào một lượng từ 2 – 3g.
- Mật độ 2.32g/cm3.
- Điểm nóng chảy 356 độ C.
- Điểm sôi 368 độ C.
- KClO3 tan nhiều trong nước nóng nhưng tan rất ít trong nước lạnh và không tan trong cồn. Do đó, khi làm lạnh dung dịch KClO3 bão hòa thì ta có thể thu được muối.
- KClO3 là loại hóa chất mạnh và tác dụng được với nhiều phi kim và kim loại như: Ca, S, P, Al, Mg,…

Cách điều chế KClO3
KClO3 thường được điều chế bằng việc cho KOH tác dụng với khí Clo ở nhiệt độ trên 80 độ C. Phương trình phản ứng điều chế như sau:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
Muối Kali Clorat cũng có thể được điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 75 độ C. Các phương trình phản ứng đó là:
2KCl +2H2O → 2KOH + H2 + Cl2
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Các ứng dụng của Kali Clorat
KClO3 được ứng dụng rất nhiều trong đời sống và sản xuất công nghiệp như sản xuất ngòi nổ, thuốc pháo, thuốc đầu diêm, thuốc giúp nhãn ra hoa.
- Ứng dụng trong chế tạo thuốc nổ, pháo hoa, ngòi nổ hay trong các hỗn hợp dễ cháy khác.
- Ứng dụng trong sản xuất diêm (KClO3 chiếm 50 % ở đầu mỗi que diêm).
- Dùng để khử màu trong dệt nhuộm vải và chất chống oxy hóa
- Ứng dụng làm chất điều hòa cây trồng, kích thích nhãn ra hoa
- Dùng để điều chế oxi trong phòng thí nghiệm bằng phương pháp nhiệt phân có sự xúc tác của MnO2
Bài tập về nhiệt phân KClO3
Bài 1: Cho phương trình hóa học: 2KClO3 → 2KCl + 3O2 .Tính khối lượng và thể tích khí Oxi thu được sau khi nhiệt phân 73,5g muối KClO3
Lời giải:
Số mol KClO3 nhiệt phân là: nKClO3 = 73,5/122,5 = 0,6(mol)
Theo phương trình hóa học ta có: nO2 = 1.5 * nKClO3 = 1.5 *0,6 = 0,9 mol
Khối lượng khí O2 thu được là: mO2 = 0,9.32 = 28,8 gam
Thể tích khí O2 thu được ở đktc là: VO2(đktc) = 0,9.22,4 = 20,16 lít.
Bài 2: Nhiệt phân hoàn toàn 24,5g KClO3 thì thu được 9,6g khí O2 và muối KCl. Tính khối lượng Kali Clorua thu được sau phản ứng.
Lời giải:
Phương trình nhiệt phân KClO3 là: 2KClO3 → 2KCl + 3O2
Theo định luật bảo toàn khối lượng: mKCl = 24,5 – 9,6 = 14,9 gam
Bài 3. Nhiệt phân KClO3.5H2O với xúc tác MnO2. Phải nhiệt phân bao nhiêu gam KClO3.5H2O để có thể thu được 6,72 lít O2 (đktc)
Lời giải:
Phương trình nhiệt phân KClO3.5H2O: 2KClO3 → 2KCl + 3O2
Số mol khí O2 ở đktc là: 6.72/22.4 = 0.3 mol
nKClO3 = ⅔ nO2 = 0.2 mol
nKClO3 = số mol KClO3.5H2O
Khối lượng KClO3.5H2O nhiệt phân là: 0,2 x 212,5 = 42,5 gam
Bài 4. Nếu sử dụng 2 chất kali pemanganat (KMnO4) và Kali clorat (KClO3) với khối lượng bằng nhau để điều chế oxi. Sử dụng chất nào cho thể tích oxi nhiều hơn.
Lời giải:
Khối lượng mol của KClO3 = 122.5 g/mol ;
Khối lượng mol của KMnO4 = 158 g/mol
Giả sử ta lấy mỗi chất một lượng là a gam
nKClO3 = a/122.5 mol;
nKMnO4 = a/158 mol
Vậy nKClO3 > nKMnO4
2KClO3 → 2KCl + 3O2↑
2KMnO4 → K2MnO4 + MnO2 + O2↑ mol
Từ các phương trình ta thấy 1 mol KClO3 điều chế được 1.5 mol O2. Trong khí đó 1 mol KMnO4 chỉ điều chế được 0.5 mol O2.
Vậy khi nhiệt phân cùng một lượng KClO3 sinh ra nhiều khí oxi hơn so với KMnO4.
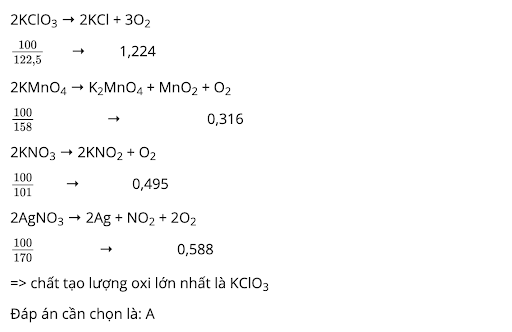
Bài 5. Khi nhiệt phân hoàn toàn 100 gam mỗi chất KClO3 (xúc tác MnO2), KMnO4, KNO3, AgNO3 thì chất tạo ra lượng oxi lớn nhất là:
A. KClO3
B. KMnO4
C. KNO3
D. AgNO3
Đáp án A
Lời giải:
Bài viết đã cung cấp đến bạn đọc những thông tin cơ bản về phản ứng nhiệt phân KClO3. Hy vọng sẽ giúp bạn nắm thêm được nhiều kiến thức hữu ích để phục vụ công việc và học tập.