Kali là một nguyên tố quen thuộc trong chương trình học phổ thông và có nhiều ứng dụng. Trong nội dung bài viết này, chúng ta sẽ tìm hiểu Kali hóa trị mấy và các tính chất của Kali nhé.
Kali (K) hóa trị mấy?
Kali là một kim loại kiềm và có những tính chất đặc trưng của một kim loại kiềm. Việc nắm được hóa trị của K sẽ giúp bạn dễ dàng viết được các công thức của hợp chất và phản ứng hóa học.
Vậy Kali hóa trị mấy?
Trả lời: Kali hóa trị 1.
Các thông tin khác về Kali:
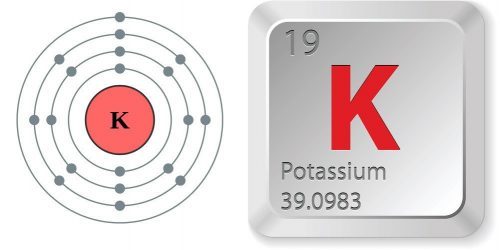
- Ký hiệu hóa học: K
- Số hiệu nguyên tử: Z = 9 thuộc chu kỳ 4 nhóm IA.
- Cấu hình electron: 1s22s22p63s23p64s1
- Nguyên tử khối: 39
- Đồng vị K : 39K, 40K, 41K .
- Độ âm điện K : 0,82
Như vậy, ta thấy lớp electron ngoài cùng của Kali có 1 electron. Do đó, Kali có xu hướng nhường 1 electron ở lớp ngoài cùng để tạo thành cấu hình khí hiếm. Đó là lý do mà Kali có hóa trị 1.
Tính chất vật lý của Kali
Kali là kim loại nhẹ thứ hai sau liti và có các tính chất vật lý như sau:
- Là chất rắn có màu trắng bạc, rất mềm và dễ dàng cắt bằng dao.
- Kali bị oxi hóa rất nhanh trong không khí nên chúng phải được bảo quản trong dầu mỏ hay dầu lửa.

Tính chất hóa học của Kali
Kali được biết đến là kim loại kiềm có tính khử rất mạnh khi dễ dàng nhường 1 electron.
K → K+ + 1e
Các tính chất hóa học của Kali đó là:
Tác dụng với nước
K tác dụng mãnh liệt với nước, tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
Phương trình hóa học:
2K + 2H2O → 2KOH + H2
Tác dụng với phi kim
Kali tác dụng với các phi kim như oxi, clo,… khi có nhiệt độ
Phương trình hóa học:
4K + O2 → 2K2O (Điều kiện nhiệt độ)
2K + Cl2 → 2KCl (Điều kiện nhiệt độ)
Tác dụng với axit
Phương trình hóa học minh họa:
2K + 2HCl → 2KCl + H2.
Tác dụng với hidro
Kali tác dụng với khí hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400 độ C tạo thành kali hidrua.
Phương trình hóa học:
2K (lỏng) + H2 (khí) → 2KH (rắn)
Điều chế Kali (K)
Kali có thể điều chế bằng cách điện phân nóng chảy kali clorua.
Phương trình hóa học:
2KCl → 2K + Cl2
Các ứng dụng của Kali
Kali có khá nhiều ứng dụng trong đời sống thường ngày
- Kali được sử dụng để sản xuất các loại phân hóa học chứa kali như clorua kali, cacbonat kali, sulfat kali,… được tính hàm lượng quy đổi theo phần trăm K2O.
- Kali nitrat được sử dụng làm thuốc súng.
- Kali cacbonat được sử dụng trong sản xuất thủy tinh.
- Thủy tinh được xử lý bằng kali lỏng sẽ có độ bền cao hơn so với những loại thủy tinh thông thường.
- Hợp kim của Kali với Natri được sử dụng như là chất truyền nhiệt trung gian.
- Kali là thành phần rất cần thiết cho sự phát triển của cây cối và được tìm thấy trong nhiều loại đất.

Bài tập vận dụng về Kali
Bài tập 1: Cho 3,9 gam kim kiềm M tác dụng vừa đủ với 12,7 g iot đun nóng. Kim loại M là chất nào?
A. Li
B. Na
C. K
D. Rb
Đáp án C
Lời giải:
Phương trình hóa học: 2M + I2 → 2MI
Số mol của iot là: nI2 = 12.7/254 = 0.05 mol
nM = 2.nI2 = 2. 0,05 = 0,1 mol
M = 39 ⇒ M là Kali
Bài tập 2: Muốn bảo quản kim loại kiềm, người ta cần phải ngâm chúng trong chất nào?
A. Dung dịch H2SO4
B. Nước tinh khiết
C. Dung dịch KOH
D. Dầu hỏa.
Đáp án D
Các kim loại kiềm thường được bảo quản bằng cách ngâm trong dầu hỏa
Bài tập 3: Cho K tác dụng với I2. Điều kiện để phản ứng xảy ra là gì?
A. Nhiệt độ phòng
B. 0 độ C
C. > 100 độ C
D. Nhiệt độ bất kì
Đáp án C
Bài tập 4: Hòa tan hoàn toàn a gam K vào 100 ml dung dịch HCl 1M, thì có V lít khí (đktc) thoát ra. Giá trị của V là bao nhiêu?
A. 1,12 lít
B. 11,2 lít
C. 5,6 lít
D. 2,24 lít
Đáp án A
Lời giải:
Phương trình hóa học: K + 2HCl → KCl + H2
Số mol khí bay ra là: nH2 = nHCl/2 = 0,1/2 = 0,05 mol ⇒ V = 0,05.22,4 = 1,12 lít
Bài tập 5: Cho a gam K tác dụng với dung dịch HCl dư thu được 2,24 lít khí đktc và m gam muối. Giá trị của m là bao nhiêu?:
A. 0,585 gam
B. 5,85 gam
C. 11,7 gam
D. 1,17 gam
Đáp án C
Lời giải:
Phương trình phản ứng: K + 2HCl → KCl + H2
nKCl = 2.nH2 = 2.0,1 = 0,2 mol
mKCl = 74,5.0,2 = 14,9 gam
Bài tập 6: Dãy chất nào sau đây chỉ gồm các kim loại tác dụng với dung dịch HCl:
A. Cu; Na, Ag
B. Na, K, Fe
C. Cu, K, Na
D. Na, Ag, Ca
Đáp án B
Lời giải:
Phương trình hóa học:
2Na + 2HCl → 2NaCl + H2;
2K + 2HCl → 2KCl + H2;
Fe + 2HCl → FeCl2 + H2.
Bài tập 7: Khi cho Kali vào 3 cốc đựng dung dịch FeCl3; ZnSO4; Al2(SO4)3 thì hiện tượng xảy ra ở 3 cốc là:
A. Có khí thoát ra
B. Có kết tủa
C. Kết tủa tan
D. hông có hiện tượng
Đáp án A
Bài tập 8: Cho m g K tác dụng với dung dịch Al2(SO4)3 thu được 0,71 gam muối. Giá trị của m là bao nhiêu?
A. 3,9 gam
B. 1,95 gam
C. 0,39 gam
D. 19,5 gam
Đáp án D
Lời giải:
Phương trình hóa học:
6K + Al2(SO4)3 + 6H2O → 3K2SO4 + H2 + 2Al(OH)3
nK = 2nK2SO4 = 0,05.2 = 0,1 mol ⇒ mK = 0,1.39 = 3,9 g
Bài tập 9: Cho K tác dụng dung dịch muối nhôm sunfat thu được kết tủa trắng. Kết tủa thu được có công thức hóa học là gì?
A. K
B. Al
C. Al(OH)3
D. Al, Al(OH)3
Đáp án A
Phương trình hóa học: 6K + Al2(SO4)3 + 6H2O → 3K2SO4 + H2 + 2Al(OH)3
Trên đây là đáp án cho câu hỏi Kali hóa trị mấy và các thông tin về tính chất, ứng dụng và điều chế Kali. Mong rằng qua bài viết này sẽ giúp bạn hiểu rõ hơn về nguyên tố Kali.