Điện phân là một khái niệm quen thuộc trong chương trình Hóa học phổ thông. Chúng ta sẽ cùng nhau tìm hiểu khái niệm, nguyên lý hoạt động, phân loại và các ứng dụng của điện phân trong đời sống hàng ngày nhé.
Khái niệm điện phân là gì?
Điện phân là quá trình chia tách một chất thành các thành phần riêng biệt thông qua việc áp dụng dòng điện một chiều đi qua chất đó. Quá trình này thường xảy ra trong một dung dịch điện phân, trong đó chất gốc bị chia tách thành các ion hoặc các hợp chất được phân tách thành các phần tử riêng lẻ.
Sự điện phân là một quá trình oxi hóa khử xảy ra ở bề mặt các điện cực khi có dòng điện một chiều đi qua dung dịch chất điện li hoặc chất điện li nóng chảy. Tuy nhiên, khác với phản ứng oxi hóa khử thông thường, phản ứng điện phân cần có thêm tác dụng của dòng điện.
Nguyên lý hoạt động của quá trình điện phân
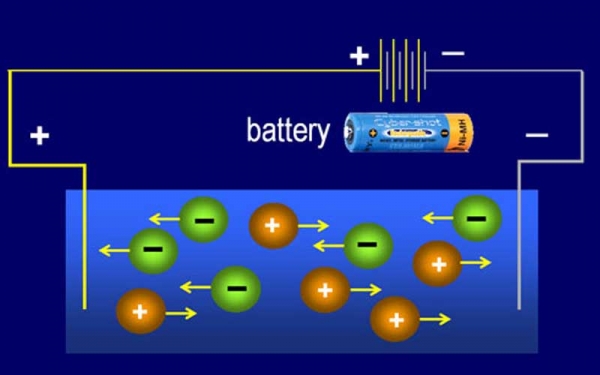
Quá trình điện phân xảy ra nhờ hiệu ứng điện ly. Khi một dòng điện đi qua một dung dịch chứa các chất phân cực, các cation (ion dương) di chuyển đến cực âm (điện cực âm), trong khi các anion (ion âm) di chuyển đến cực dương (điện cực dương). Quá trình này tạo ra sự chia tách chất và tạo thành hai khu vực có tính chất khác nhau trong dung dịch: khu vực giàu cation và khu vực giàu anion.
Tại catot xảy ra quá trình khử cation với công thức như sau:
Mn+ + ne → M
Tại anot xảy ra quá trình oxi hóa anion với công thức như sau:
Xn- → X + ne
Công thức Faraday tính lượng chất được điện phân
Để tính lượng chất được điện phân, ta sử dụng công thức Faraday. Công thức này cho biết lượng chất được điện phân (m) tỉ lệ thuận với số điện tích q đi qua dung dịch và tỉ lệ nghịch với hằng số điện li của chất (F). Công thức được viết như sau:
m = q * F
Trong đó:
m là lượng chất được điện phân (mol)
q là số điện tích (Coulomb)
F là hằng số Faraday (96,485 Coulomb/mol)
Hiện tượng xảy ra trong quá trình điện phân
Trong quá trình điện phân, có một số hiện tượng quan trọng xảy ra như khí thoát ra từ điện cực, sự thay đổi pH trong dung dịch và sự kết tủa của các chất. Ví dụ, khi điện phân dung dịch muối natri clorua (NaCl), ở cực âm sẽ có sản phẩm phản ứng là hidro clorua (HCl) màu trắng, trong khi ở cực dương sẽ có sản phẩm phản ứng là oxit natri (Na₂O) và clo (Cl₂) màu vàng.
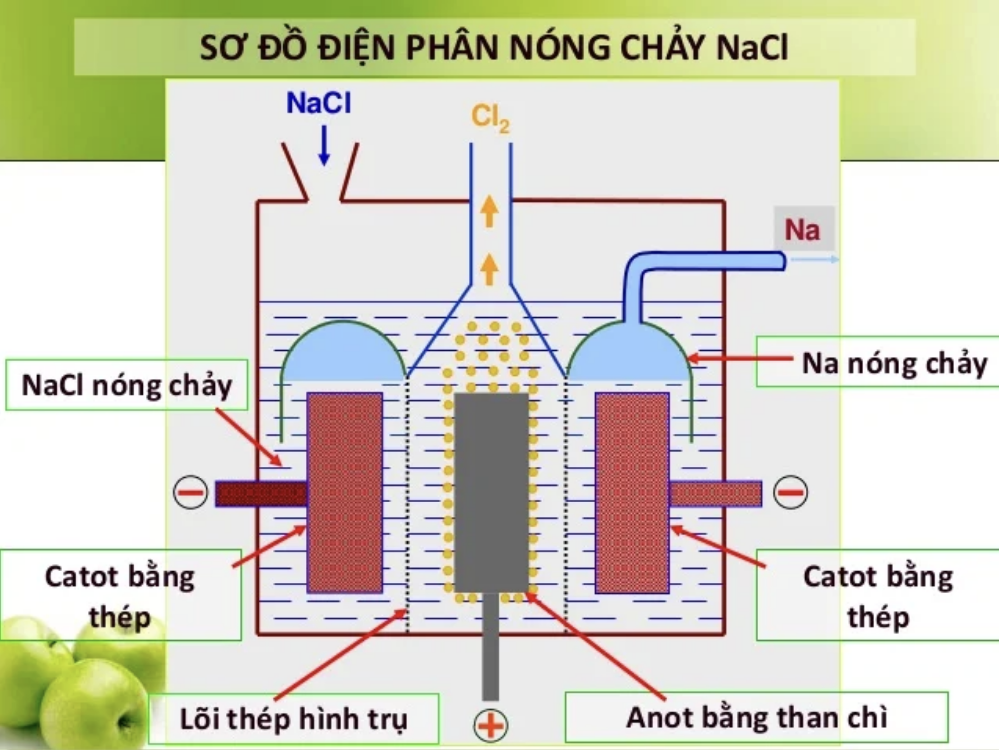
Các loại điện phân
Điện phân cực
Điện phân cực là quá trình điện phân trong đó cực âm và cực dương được làm bằng hai chất khác nhau. Trong điện phân cực, các ion di chuyển từ cực âm đến cực dương thông qua dung dịch điện phân. Ví dụ về điện phân cực là quá trình điện phân nước (H₂O) thành hydro (H₂) và oxi (O₂).
Điện phân không cực
Điện phân không cực là quá trình điện phân trong đó cùng một chất được sử dụng làm cả cực âm và cực dương. Trong điện phân không cực, các ion di chuyển theo hai hướng ngược nhau thông qua dung dịch điện phân. Ví dụ về điện phân không cực là quá trình điện phân dung dịch muối natri clorua(NaCl) trong đó các ion natri (Na+) di chuyển từ cực âm đến cực dương, trong khi các ion clorua (Cl-) di chuyển từ cực dương đến cực âm.
Thiết bị sử dụng trong quá trình điện phân
Trong quá trình điện phân, có nhiều thiết bị được sử dụng để tạo ra dòng điện và tách chất. Các thiết bị này bao gồm:
- Nguồn điện: Đây là nguồn cung cấp điện năng cho quá trình điện phân. Thông thường, nguồn điện được sử dụng là nguồn điện một chiều (DC), như pin hoặc nguồn điện xoay chiều (AC) kết hợp với mạch chỉnh lưu để biến đổi thành nguồn DC.
- Điện cực: Có hai loại điện cực chính được sử dụng trong quá trình điện phân, bao gồm điện cực âm và điện cực dương. Điện cực thường được làm bằng vật liệu dẫn điện như carbon, kim loại hoặc cao su.
- Dung dịch điện phân: Dung dịch điện phân là môi trường chứa chất cần được điện phân. Dung dịch này có thể là dung dịch muối, dung dịch axit, dung dịch kiềm hoặc dung dịch hữu cơ tùy thuộc vào ứng dụng cụ thể.
- Bể điện phân: Đây là nơi chứa dung dịch điện phân và các điện cực. Bể điện phân thường có thiết kế đặc biệt để đảm bảo sự hiệu quả của quá trình điện phân.
Ứng dụng của điện phân
Quá trình điện phân có rất nhiều ứng dụng trong các lĩnh vực khác nhau. Dưới đây là một số ví dụ về ứng dụng của điện phân:
- Tạo kim loại: Quá trình điện phân được sử dụng để sản xuất các kim loại từ quặng. Ví dụ, quá trình điện phân nhôm (Al) từ quặng bauxite thông qua phương pháp điện phân nóng chảy.
- Tinh lọc kim loại: Quá trình điện phân cũng được sử dụng để tinh lọc các kim loại. Ví dụ, quá trình điện phân được áp dụng trong quá trình tinh lọc đồng (Cu) để loại bỏ tạp chất và sản xuất đồng tinh khiết.
- Sản xuất chất hóa học: Điện phân cũng được sử dụng để sản xuất các chất hóa học quan trọng như clo (Cl₂) và kiềm (NaOH) thông qua quá trình điện phân dung dịch muối natri clorua (NaCl).
- Nhuộm mạ: Quá trình điện phân được áp dụng trong việc nhuộm mạ, tức là tạo một lớp mạ bảo vệ trên bề mặt của các vật liệu kim loại, như thép, để ngăn chặn quá trình rỉ sét.
Bài tập về điện phân
Bài 1: Viết sơ đồ điện phân nóng chảy NaCl
Catot ( – ) ← NaCl → Anot ( + )
2Na+ + e → Na 2Cl- → Cl2 + 2e
Phương trình điện phân nóng chảy NaCl là:
2NaCl → 2Na + Cl2
Bài 2: Viết sơ đồ điện phân dung dịch CuCl2
Catot ( – ) ← CuCl2 → Anot ( + )
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
Phương trình điện phân dung dịch CuCl2 là:
CuCl2 → Cu + Cl2
Bài 3. Điện phân nóng chảy Al2O3, dư với dòng điện có I = 19,3A; thời gian là 20 giờ. Khối lượng nhôm thu được là bao nhiêu?:
A. 129,6 gam
B. 162,0 gam
C. 324,0 gam
D. 108,0 gam
Đáp án A
Lời giải
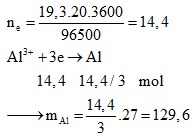
Bài 4. Điện phân dung dịch CuCl2 với điện cực trơ, sau một thời gian thu được 0,32 gam Cu ở catot và một lượng khí X ở anot. Cho khí X hấp thụ hoàn toàn vào 200ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,05 M (giả thiết thể tích dung dịch không thay đổi). Nồng độ ban đầu của dung dịch NaOH là bao nhiêu?
A. 0,15M
B. 0,2M
C. 0,1M
D. 0,05M
Đáp án C
Lời giải:

Trên đây là các thông tin tổng quan về điện phân, bao gồm khái niệm, nguyên lý hoạt động, công thức tính lượng chất được điện phân, hiện tượng quan sát được trong quá trình điện phân, các loại điện phân, thiết bị sử dụng và ứng dụng của quá trình điện phân và các bài tập vận dụng.
Qua việc tìm hiểu về điện phân, chúng ta nhận thấy rằng quá trình này mang lại nhiều ứng dụng quan trọng trong ngành công nghiệp và khoa học. Việc hiểu rõ về nguyên tắc hoạt động và các ứng dụng của điện phân sẽ giúp chúng ta áp dụng và khai thác tối đa tiềm năng của quá trình này.